Algunos inmunomoduladores incorporados al manejo de las formas más graves de COVID-19
lunes , 27 de abril de 2020

Algunos inmunomoduladores incorporados al manejo de las formas más graves de COVID-19
En los últimos tres meses se han producido cambios fundamentales en el conocimiento de la infección COVID-19, aunque esta sigue siendo bastante poco comprendida. Actualmente, han comenzado a ensayarse, o están próximas a hacerlo, varias posibles vacunas y nuevas tecnologías para lograr una detección rápida y con garantías de la enfermedad, pero son muchas las incertidumbres que siguen angustiando a la sociedad. Una de las más importantes afecta a la generación, grado y duración de la protección que producen los anticuerpos neutralizantes, y otra se debe al hecho de que, hasta el momento, no se haya encontrado un fármaco suficientemente eficaz. Sin embargo, los tratamientos evolucionan día a día, y creemos que merece la pena hacer un seguimiento de esa evolución desde la RANF.
Seguir leyendo
En una reciente publicación en nuestros Anales, comentábamos el uso de varios fármacos antivirales, mencionando brevemente algunos inmunosupresores (1). El doctor Antonio R. Martínez, nuestro actual Secretario, publicó en el Noticiero Semanal Académico surgido para mantener vivo el contacto Academia/académicos, un interesante artículo sobre la utilización de la cloroquina/hidroxicloroquina en la profilaxis y tratamiento de la infección por este nuevo virus patógeno (2). El doctor Menéndez Ramos amplió las características y el potencial de uno de los antivirales más prometedores en el Noticiero publicado el 13 de abril pasado (3), (aunque el 23 llegaron malas noticias acerca de uno de sus ensayos clínicos), y la doctora Saelices analizó el uso de los anticuerpos monoclonales Tocilizumab (RoActemra®) y Sarilumab (Kevzara®), bloqueantes de los receptores de IL-6 en el siguiente Noticiero (4).
La práctica clínica está demostrando que el uso de antivirales puede resultar un fracaso si estos se administran cuando está ya en marcha una respuesta inmune devastadora, caracterizada por una “tormenta de citocinas” a la que se enfrentan algunos pacientes. SARS-CoV-2 produce el síndrome de activación macrofágica al ser capaz de infectar, entre otras, a las células inmunes, donde presumiblemente crea un reservorio para poder replicarse. Esta situación parece originar un estrés celular que, a su vez, provocaría una respuesta inflamatoria/inmune disfuncional que amplificaría el daño producido por el virus, sin resolver la infección. Por esta razón, el uso de terapias inmunosupresoras en el manejo de las formas más graves de la enfermedad está siendo relevante (5).
Entre los inmuno-moduladores que se han incorporado a los ensayos clínicos para intentar resolver o paliar este problema se encuentra la ciclosporina A, cuyo uso está aprobado para la prevención del rechazo de trasplantes alogénicos y de enfermedades autoinmunes e inflamatorias (6), con la que se inició un ensayo clínico el 20 de abril, promovido por el Instituto de Investigación Sanitaria Fundación Jiménez Díaz y financiado por la Fundación Tatiana Pérez de Guzmán el Bueno, que evaluará su eficacia para disminuir el daño pulmonar y cardiaco asociado a la mortalidad de los pacientes con COVID19.
En este Noticiero vamos a centrarnos en un fármaco muy poco conocido denominado Opaganib (ABC294640, Yeliva®), cuya tolerabilidad se estableció en los ensayos de fases 1 y 2 realizados en los años 2010-2015 para definir su actividad como antiinflamatorio (7), antiviral, y antitumoral (8). De hecho, este fármaco se declaró por la FDA orphan drug para el cáncer de vías biliares (colangiocarcinoma).
Al inicio de la pandemia provocada por SAR-CoV-2, se administró compasivamente Opaganib a cinco pacientes infectados en Israel, junto al tratamiento estándar, que incluía hidroxicloroquina como terapia de base, produciendo una notable mejora clínica en cuatro de los cinco pacientes los días siguientes al inicio del tratamiento. Estos rebajaron la necesidad de oxígeno y los niveles de proteína C-reactiva, indicando una menor inflamación, y aumentaron los niveles de linfocitos. RedHill Biopharma, la empresa que lo desarrolla, expandió entonces su uso compasivo al norte de Italia y, al mismo tiempo, ha solicitado autorización a la FDA para obtener datos clínicos más robustos y controlados en EEUU a través de un ensayo en fase 2 aleatorio, doble ciego y controlado por placebo, en pacientes SARS-CoV-2 positivos hospitalizados con neumonía.
El mecanismo de acción de Opaganib nos obliga a conectar con la desregulación del metabolismo de los esfingolípidos, ya que es un inhibidor selectivo de la esfingosina cinasa-2 (SphK2) (9), una de las dos isoformas de la enzima que catalizan la conversión de esfingosina en esfingosina 1-fosfato (S1P) cuyo potencial para promover la replicación vírica se ha demostrado a nivel preclínico (10).
En respuesta a estímulos inflamatorios, la esfingomielina se hidroliza y produce ceramidas, que inducen la apoptosis de células tumorales (figura 1). Las ceramidas se hidrolizan a esfingosina, un aminoalcohol con 18 átomos de carbono que, por acilación de su grupo amino, se transfroma en ceramida (con actividad apoptótica) y, por fosforilación de su grupo funcional 1-OH catalizada por las cinasas SphK1 (citosólica) o SphK2 (nuclear y citosólica), se convierte en S1P (con actividad proliferativa) (11). El balance entre S1P y ceramida regula el destino de muchos tipos de células y está implicado en el desarrollo de ciertas enfermedades. Aunque los esfingolípidos actúan sobre algunas dianas intracelulares como segundos mensajeros, la principal actividad biológica de S1P se debe a su interacción con la familia de receptores de membrana acoplados a proteína G denominados S1PR1-5. Dicha interacción activa diversas vías de señalización y promueve, por ejemplo, la síntesis de citocinas proinflamatorias como TNF-α e IL-6 y la activación del factor de transcripción STAT3 (12).
En la figura 1, que resume el mecanismo de acción a nivel molecular de Opaganib, los lípidos y transformaciones proliferativas y proinflamatorias están marcados en azul. Opaganib inhibe dos enzimas: la cinasa SphK2 y la dihidroceramida desaturasa, reduciendo los niveles de S1P y aumentando los de ceramidas, especialmente dihidroceramidas (13).
Figura 1: Metabolismo de esfingolípidos. Mecanismo de acción de Opaganib
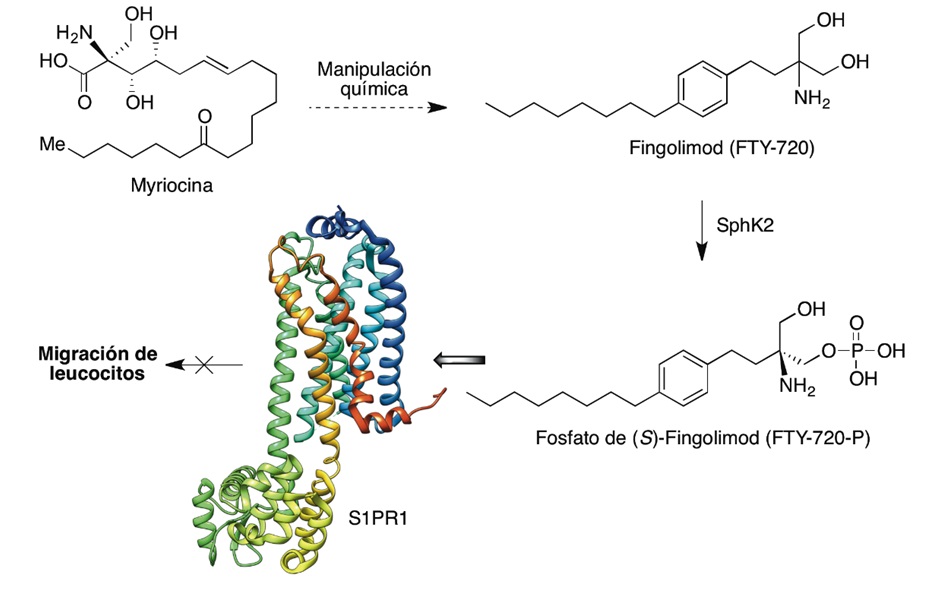
Antes de que se conociera Opaganib, se había descubierto el Fingolimod (FTI720, Gilenya®) un profármaco que se denominó así por su relación estructural con la esfingosina y fue el primer tratamiento oral aprobado por la FDA, en 2010, para combatir las formas recurrentes de esclerosis múltiple (14). Aunque parece que no se ha ensayado su uso contra COVID-10, vamos a comentarlo brevemente dada su estrecha relación con Opaganib. Fingolimod se originó en la manipulación química del metabolito fúngico miriocina, un inmunosupresor aislado de cultivos del ascomiceto Isaria sinclairii, dentro de un programa de búsqueda de compuestos potencialmente útiles en el tratamiento de enfermedades autoinmunes y en el trasplante de órganos, a partir de productos naturales aislados de distintos hongos. En este programa se hizo necesario mantener la actividad inmunosupresora de la miriocina para optimizar sus propiedades farmacocinéticas y disminuir su toxicidad, ya que es tóxica y muy poco soluble. En los primeros ensayos preclínicos, Fingolimod mostró un comportamiento distinto al de otros inmunosupresores. No inhibía la proliferación y activación de los linfocitos T y B ni la producción de citocinas o anticuerpos, ni tampoco modificaba la actividad de la serina palmitoil transferasa como lo hacía miriocina, pero sí inhibía el tráfico entre los órganos linfoides y la sangre. Los estudios para determinar su mecanismo de acción a nivel molecular demostraron que se activa por fosforilación catalizada por SphK2 para convertirse en su metabolito activo (FTY720-P), que compite con S1P para interaccionar con sus cinco subtipos de receptores, siendo particularmente importante su interacción con los receptores S1PR1 en los timocitos y linfocitos porque produce la internalización aberrante de dichos receptores y deja a la célula sin receptores disponibles para la acción del ligando endógeno esfingosina fosfato, lo que impide finalmente la migración de los leucocitos a los tejidos inflamatorios periféricos (15).
Figura 2: Mecanismo de acción de Fingolimod
El paso de los linfocitos T vírgenes (Tn) y de los linfocitos T centrales de memoria (TCM) desde los ganglios linfáticos a la linfa es un proceso dependiente de los receptores S1PR1, y cuando éstos se eliminan por la acción del Fingolimod, los linfocitos quedan retenidos dentro de los ganglios y no pueden generar un daño inflamatorio. La estimulación de los receptores S1PR1 por S1P contrarresta, en los linfocitos, las señales de retención mediadas por el receptor CCR7 (receptor de quimiocinas C-C tipo 7) y otros receptores acoplados a Gαι (16). Por tanto, si estos receptores se inhiben, hay menos linfocitos autoreactivos circulantes que puedan generar un daño inflamatorio.
Referencias
1. Avendaño, C. Aportaciones de las ciencias biomédicas en el estado de alarma motivado por la pandemia del virus SARS-COV-2. Anales RANF 2020; 86: 9-17.
2. Martínez, A. R. La segunda resurrección de la cloroquina. Noticiero Semanal Académico 06/04/2020.
3. Menéndez, J. C. El remdesivir, un antiviral prometedor contra la Covid-19. Noticiero Semanal Académico 13/04/2020.
4. Saelices, M. Tormenta de citoquinas y COVID-19. Noticiero Semanal Académico 20/04/2020.
5. Mehta, P.; McAuley, D. F.; Brown, M.; Sánchez, E.; Tattersall, R. S.; et al. COVID-19: consider cytokine storm syndromes and immunosuppression. Lancet 2020; 395: 1033-1034.
6. Sánchez-Pernaute, O.; Romero-Bueno, F.; O’Callaghan, S. Why choose cyclosporin A as first-line therapy in COVID-19 pneumonia. Reumatologia Clinica 2020; 02.001.
7. (a) Maines, L. W.; Fitzpatrick, L. R.; Green, C. L.; Zhuang, Y.; Smith, C. D. Efficacy of a novel sphingosine kinase inhibitor in experimental Crohn’s disease. Inflammopharmacology 2010; 18: 73–85. (b) Fitzpatrick, L. R.; Green, C.; Frauenhoffer, E. E.; French, K. J. Zhuang ,Y.; et al. Attenuation of arthritis in rodents by a novel orally-available inhibitor of sphingosine kinase. Inflammopharmacology 2011; 19: 75-87. (c) Liu, Q.; Rehman, H.; Shi, Y.; Krishnasamy, Y.; Lemasters, J. J.; et al. Inhibition of sphingosine kinase-2 suppresses inflammation and attenuates graft injury after liver transplantation in rats. PLoS ONE 2012; 7: e41834.
8. (a) French, K. J.; Zhuang, Y.; Maines, L. W.; Gao, P.; Wang, W.; et al. Pharmacology and antitumor activity of ABC294640, a selective inhibitor of sphingosine kinase-2. Journal of Pharmacology and Experimental Therapeutics 2010, 333: 129-139. (b) Venant, H.; Rahmaniyan, M.; Jones, E. E.; Lu, P.; Lilly, M. B.; et al. The sphingosine kinase 2 inhibitor ABC294640 reduces the growth of prostate cancer cells and results in accumulation of dihydroceramides in vitro and in vivo. Mol. Cancer Ther. 2015; 14: 2744-2752.
9. Neubauer, H. A.; Pitson, S. M. Roles, regulation and inhibitors of sphingosine kinase 2. FEBS J. 2013; 280: 5317-5336.
10. Xia, Ch.; Seo, Y.-J.; Studstill, C. J.; Vijayan, M.; Wolf, J. J.; et al. Transient inhibition of sphingosine kinases confers protection to influenza A virus infected mice. Antiviral Res. 2018; 158: 171-177.
11. (a) Obeid, L. M.; Lindaric, C. M.; Karolak, L. A.; Hannun, Y. A. Programmed cell death induced by ceramide. Science 1993; 259: 1769-1771. (b) Zhang, H.; Desai, N. N.; Olivera, A.; Seki ,T.; Brooker, G.; Spiegel, S. Sphingosine-1-phosphate, a novel lipid, involved in cellular proliferation. J. Cell Biol. 1991; 114: 155-167.
12. Rosen, H.; Stevens, R. C.; Hanson, M.; Roberts, E.; Oldstone, M. B. Sphingosine-1- phosphate and its receptors: structure, signaling, and influence. Annu. Rev. Biochem. 2013; 82: 637-662.
13. Britten, C. D.; Harrett-Mayer, E.; Chin, S. H.; Shirai, K.; Ogretmen, B.; et al. A phase I study of ABC294640, a first-in-class Sphingosine Kinase-2 inhibitor, in patients with advanced solid tumors. Clin. Cancer Res. 2017; 23: 4642-4650.
14. Brinkmann, V.; Billich, A.; Baumruker, T.; Heining, P.; Schmouder, R.; et al. Fingolimod (FTY720): discovery and development of an oral drug to treat multiple sclerosis” Nat. Rev. Drug Discov. 2010, 9: 883-897.
15. Matloubian, M.; Lo, C. G.; Cinamon, G.; Lesneski, M. J.; Xu, Y.; et al. Lymphocyte egress from thymus and peripheral lymphoid organs is dependent on S1P receptor 1. Nature 2004, 427: 355-360.
16. Pham, T. H.; Okada, T.; Matloubian, M.; Lo, C. G.; Cyster, J. G. “S1P1 receptor signaling overrides retention mediated by Gi-coupled receptors to promote T cell egress” Immunity 2008, 28: 122-133.
Carmen Avendaño López
Académica de la RANF