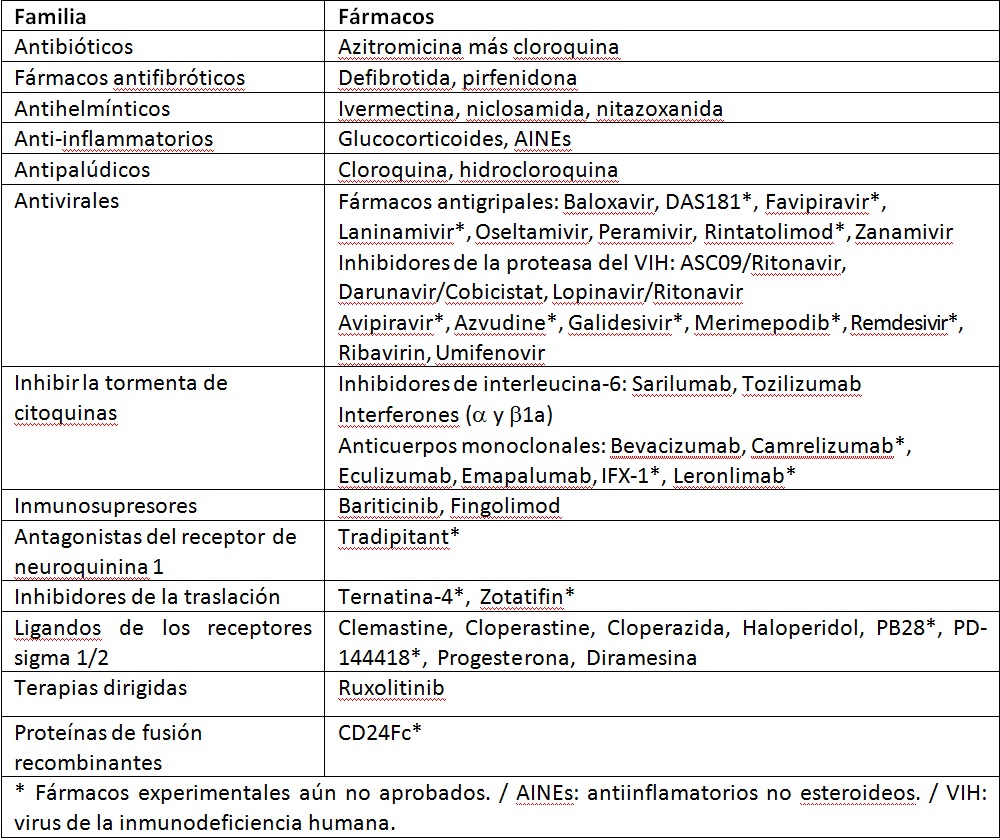
Tabla 1. Fármacos en fase de estudio para el tratamiento del Covid-19
A continuación me gustaría hacer algunas reflexiones farmacológicas sobre lo acontecido en los últimos tres meses.
El primer hecho que quiero resaltar es el continuo baile de contradicciones. El 14/03/2020, cuando algunos afirmaban que el Covid-19 producía un cuadro gripal banal que podría tratarse con antiinflamatorios convencionales, el Ministro de la Salud francés, Olivier Véran, afirmó que los medicamentos antiinflamatorios, como el ibuprofeno o los glucocorticoides, podrían agravar la infección por el Covid-19 y, el 18/03/2020, la OMS recomendó usar acetaminofeno en lugar de ibuprofeno, aunque horas después retiró esa declaración. Sin embargo, el 14/04/2020, el Grupo de Trabajo de Expertos de la Comisión de Medicamentos Humanos sobre Covid-19 concluyó que no había razones para vincular el ibuprofeno u otros medicamentos antiinflamatorios no esteroideos a un mayor riesgo en pacientes con Covid-19. Por otro lado, la guía provisional de los ‘Centers for Disease Control and Prevention’ (CDC) sobre el abordaje del paciente con enfermedad confirmada por Covid-19 (actualizada a fecha del 7/03/2020) establecía que se deberían evitar los corticosteroides, debido a la posibilidad de prolongar la replicación vírica, como se observa en pacientes con MERS-Cov, a menos que se indiquen por otras razones. Sin embargo, el 16/06/2020 el estudio RECOVERY ha demostrado que “la vieja dexametasona” podría reducir en un 35% la mortalidad en pacientes ventilados y en un 20% en los que reciben oxigenoterapia, aunque no la modifica en pacientes que no requieren soporte ventilatorio.
La segunda contradicción apareció el 11/03/2020 cuando, en una carta publicada en ‘The Lancet Respiratory Medicine’, se lanza la hipótesis de que los pacientes tratados con inhibidores de la ECA (IECAs) y bloqueadores de los receptores de la angiotensina II tipo 1 (ARAII) podrían tener un mayor riesgo de desarrollar infección grave y mortal por el Covid-19. La hipótesis se basaba en que la enzima convertidora de angiotensina 2 (ACE2) es el receptor responsable de la entrada del SARS-CoV en las células y su expresión aumenta en pacientes tratados con IECAs o ARAII. Por si fuera poco, en la carta se mencionaba que los IECAs podrían, además, modificar la respuesta inmune adaptativa en los afectados por Covid-19. El artículo causó gran revuelo. El resultado fue que algunos pacientes con hipertensión arterial, insuficiencia cardiaca, diabetes o insuficiencia renal abandonaron el tratamiento con IECAs/ARAII, fármacos que reducen la morbimortalidad en estas poblaciones. En la actualidad disponemos de estudios que confirman que IECAs y ARAII no aumentan la morbimortalidad en pacientes con Covid-19, lo que me lleva a plantear ¿por qué una revista prestigiosa aceptó publicar una hipótesis no contrastada con consecuencias tan graves para la población con patología cardiovascular o renal previa, que son los más propensos a desarrollar los cuadros infecciosos más graves?
El tercer ejemplo es la cloroquina/hidroxicloroquina, que hace tres meses se recomendaba como una panacea, lo que condujo al desabastecimiento en las farmacias. Sin embargo, son varios los estudios que cuestionan su eficacia y, este mismo mes, dos artículos han confirmado que la hidrocloroquina es inefectiva, pero aumenta la incidencia de reacciones adversas, en particular las digestivas y cardiacas. Y debo recordar que el Covid-19 produce múltiples alteraciones cardiacas y que la infección por el Covid-19 es mucho más grave en los pacientes con cardiopatías. Ello ha llevado a que, el 26/04/2020, la OMS suspendiera el brazo tratado con hidrocloroquina en el estudio SOLIDARITY hasta que se aclare su seguridad cardiaca. Este es un excelente ejemplo de que no se puede extrapolar la seguridad de fármacos aprobados para otras indicaciones (ataque agudo de malaria, artritis reumatoide, lupus eritematoso sistémico y discoide) a lo que podría suceder en pacientes con una infección vírica.
Dado que nos enfrentamos a coronavirus, la primera reacción ha sido evaluar clínicamente fármacos que inhiban el SARS-CoV2 (algo que era desconocido el pasado mes de enero) utilizando antivirales de amplio espectro, algunos de ellos previamente aprobados para el tratamiento de otras infecciones producidas por virus RNA, como influenza o VIH, o medicamentos aprobados para otras indicaciones clínicas pero que exhiben potentes efectos antivirales de amplio espectro (tabla 1). Por otro lado, la infección grave causada por el Covid-19 se asocia, en algunos casos muy graves, a una infiltración celular inflamatoria masiva asociada a concentraciones plasmáticas muy elevadas de citocinas/quimiocinas (la denominada tormenta de citocinas), que conducen a un fallo multiorgánico potencialmente mortal y del que forman parte la lesión pulmonar aguda y el síndrome de dificultad respiratorio agudo. La demostración de que la elevación en los niveles plasmáticos de interleucina (IL)-6 puede predecir la progresión de la enfermedad en pacientes con Covid-19 ha llevado a proponer la estrategia terapéutica de controlar la tormenta de citocinas utilizando antagonistas de los receptores de IL-6, inmunosupresores, interferones o fingolimod y ello a pasar de que estos fármacos pueden aumentar el riesgo de infecciones.
Llegados a este punto, me gustaría seguir haciéndome algunas reflexiones y preguntas acerca de los ensayos clínicos actualmente en marcha.
1) La primera pregunta es si los efectos antivirales observados frente al SARS-CoV2 en sistemas de expresión ‘in vitro’ podrían lograrse ‘in vivo’. Con algunos antivirales ya comercializados o en desarrollo, las dosis a las que inhiben el SARS-CoV ‘in vitro’ son mucho más altas que los niveles terapéuticos plasmáticos alcanzados a las dosis recomendadas en pacientes, por lo que su efectividad clínica, si la hubiera, vendría acompañada de reacciones adversas, aunque desconozcamos su gravedad potencial. Pero el problema no son los niveles plasmáticos, sino la distribución tisular del fármaco. ¿Puede el fármaco alcanzar niveles terapéuticos a nivel pulmonar? Sin embargo, adelanto que la distribución tisular (pulmonar) de la mayoría de los fármacos en estudio es desconocida, por lo que es difícil aventurar su eficacia.
2) Algunos fármacos estaban en fase experimental o estaban aprobados para otras indicaciones y, lógicamente, se me ocurren dos preguntas. La primera es ¿cómo se ha calculado la dosis más efectiva y segura en pacientes con Covid-19? La respuesta es que, lógicamente, con la mayoría de los fármacos no existía una curva dosis-respuesta realizada en pacientes con Covid-19, por lo que se han realizado extrapolaciones basadas en modelos PK/PD. Ello explica por qué, en ocasiones, existen importantes diferencias en las dosis utilizadas de un mismo fármaco en los diversos ensayos clínicos, por lo que no debería sorprendernos que resultara efectivo en un ensayo y neutro en otro, o que la incidencia de reacciones adversas pudiera variar en los distintos estudios. La segunda pregunta es ¿cuál será el perfil de seguridad en pacientes con Covid-19? Hay quien afirma que la seguridad de algunos fármacos es bien conocida, pero se olvida que esa era la seguridad en pacientes sin Covid-19 y es bien sabido que la seguridad de un fármaco puede variar según la patología a tratar. Debemos tener en cuenta que los pacientes con Covid-19 y enfermedades cardiovasculares preexistentes tienen un mayor riesgo de desarrollar síntomas graves y muerte y el Covid-19 ‘per se’ produce graves complicaciones cardiovasculares, incluyendo cardiopatía isquémica, miocarditis, arritmias y tromboembolismos arteriovenosos. Y algunos fármacos en estudio producen efectos adversos cardiovasculares y no cardiovasculares graves (hepatotoxicidad, neutropenia, mayor riesgo de infecciones). Por otro lado, el perfil de seguridad de los medicamentos no aprobados por la FDA o la Agencia Europea de Medicamentos, sigue siendo incierto ya que han sido estudiados en pacientes sin infección por el Covid-19.
3) Cada día se publican los resultados de estudios observacionales o estudios retrospectivos no aleatorizados que adolecen de problemas metodológicos importantes ya que, con frecuencia, son abiertos y/o carecen de comparador activo e incluyen un número reducido de pacientes (< 50) lo que limita el poder para detectar diferencias significativas. Lo más importante son las marcadas diferencias en los criterios de inclusión/exclusión y en los objetivos primarios que existen entre los distintos estudios, así como en el tratamiento hospitalario recibido (diferentes dosis, duración del tratamiento o vías de administración), lo que de nuevo dificulta la comparación e interpretación de los resultados.
4) Los objetivos de muchos ensayos clínicos se centran en el tiempo hasta la resolución de los síntomas, la mejoría de las alteraciones bioquímicas o radiográficas, o la reducción del uso de ventilación mecánica, pero muy pocos están diseñados para analizar, de forma prospectiva, si el fármaco estudiado es capaz de reducir la mortalidad. Además, la mayoría de los ensayos van dirigidos al tratamiento, no a la prevención de futuros rebrotes de la infección.
5) Como consecuencia de la gran presión para publicar antes que otros grupos, estamos asistiendo a que algunos resultados se publiquen en revistas sin revisión por pares, lo que para mí claramente limita su interés, y a que algunos autores tengan que retractarse, por diversos motivos, de sus propios hallazgos, lo que añade un toque de desconfianza hacia la avalancha de publicaciones que se nos viene encima. A esta desconfianza contribuyen algunos resultados tan espectaculares que cuesta trabajo aceptarlos. Este es el caso de un estudio realizado en 21 pacientes en el que se afirmaba que el 91% de los pacientes eran dados de alta 13.5 días después del tratamiento con Tocilizumab (400 mg i.v.) y ello se conseguía en la mayoría de los pacientes “con una única dosis” del fármaco.
En conclusión, el Covid-19 es una nueva pandemia y, dado que hasta la fecha no disponemos de un tratamiento efectivo, la búsqueda de nuevos fármacos se ha convertido en una prioridad de salud pública. Los científicos se enfrentan al desafío de comprender mejor las características de este nuevo virus y la fisiopatología de una enfermedad que conduce, en ocasiones, a un fallo multiorgánico potencialmente mortal, para así identificar nuevas dianas terapéuticas y desarrollar sobre bases científicas fármacos eficaces y seguros. Entre tanto, seguimos “disparando en la oscuridad contra un enemigo al que desconocemos”. Espero que los resultados de los ensayos prospectivos, aleatorizados y controlados en curso permitirán conocer la eficacia y seguridad de los fármacos en estudio e identificar a los pacientes que más se beneficiarán del tratamiento.
Juan Tamargo
Académico de la RANF


