Combinar la versatilidad de las nanoparticulas de sílice mesoporosa con la acción de las bacterias puede activar el sistema inmune, ofrecer la posibilidad de modificaciones genéticas y conseguir efectos sinérgicos que den lugar a terapias muy prometedoras.
La capacidad de autopropulsión y guía de las células y las bacterias les permite penetrar en los tejidos vivos independientemente de las consideraciones hidrodinámicas; el uso de bacterias como portadoras de fármacos puede llegar a constituir una terapia antitumoral.
Además, estos minúsculos organismos son capaces de moverse como respuesta a pequeños cambios con un estímulo interno (sustancias químicas específicas, variaciones de temperatura o pH), o guiados por estímulos externos, como por ejemplo un campo magnético. Así, las bacterias anaerobias son capaces de colonizar regiones hipóxicas en tejidos tumorales, alcanzando zonas internas de la malignidad, tanto in vitro como in vivo.
Estos diminutos organismos han sido ampliamente estudiados para el tratamiento del cáncer debido a su capacidad potencial de alcanzar incluso el núcleo difícilmente accesible de los tumores sólidos. Las bacterias presentan una notable capacidad de alojamiento en tumores guiadas por las condiciones específicas presentes en ellas, como el entorno necrótico e hipóxico.
En un reciente trabajo (Moreno et als., 2020) acabamos de presentar una novedosa estrategia para mejorar la penetración de las nanopartículas de sílice mesoporosa cargadas de fármacos en modelos tridimensionales de matriz tumoral de colágeno, a través de su fijación covalente en la superficie de las bacterias vivas.
En nuestro estudio hemos utilizando Escherichia coli como modelo de bacterias anaerobias facultativas para el transporte de nanopartículas de sílice mesoporosas cargadas con un potente compuesto citotóxico, la doxorrubicina.
En este trabajo, la pared de las bacterias la decoramos con grupos de azida para permitir el anclaje covalente de las nanopartículas de sílice mesoporosas funcionalizadas con reacciones de tipo clic de cicloalcino colado. La alta quimioselectividad de la cicloadición azide-alquina permitió la fácil incorporación de nanopartículas cargadas con fármacos citotóxicos en condiciones suaves en la superficie de las bacterias vivas. La capacidad de transportar las nanopartículas a zonas profundas de la matriz tumoral la hemos evaluado empleando modelos tumorales tridimensionales, compuestos por una densa matriz de colágeno que contiene células de fibrosarcoma humano incrustadas en la matriz orgánica.
Los resultados indicaron que las nanopartículas transportadas por las bacterias se encontraban homogéneamente distribuidas en todo el tejido, incluso en las zonas profundas, mientras que los nanoportadores libres se concentraban sólo en la periferia.
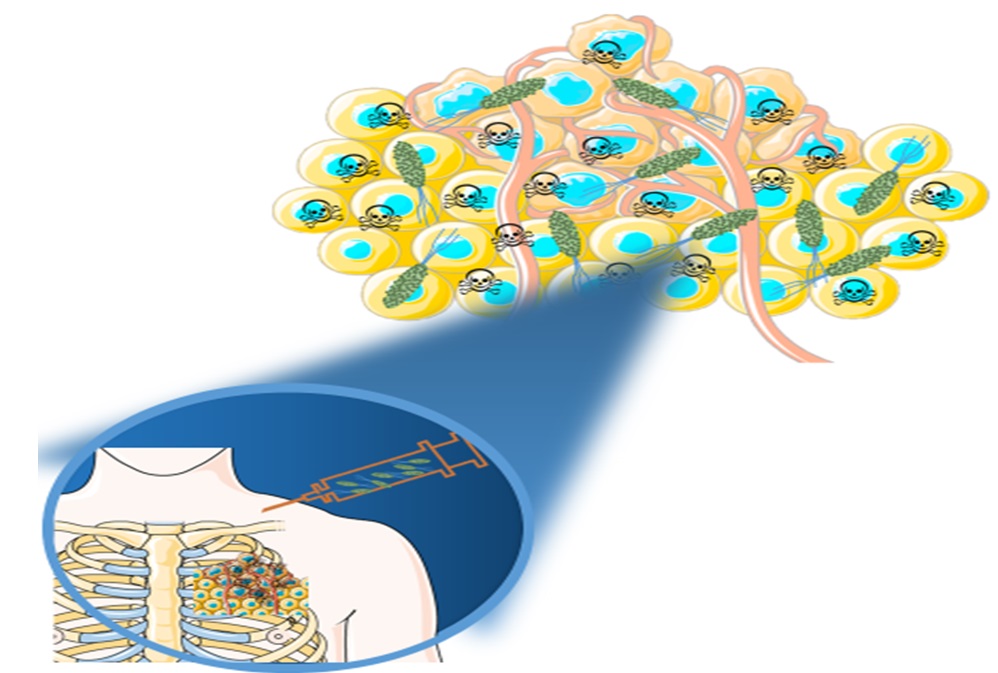
La capacidad de las bacterias para transportar nanopartículas dentro de matrices de colágeno denso puede llegar a ser una valiosa estrategia para mejorar la eficacia de los nanomedicamentos en la lucha contra muchas enfermedades.
Para una futura aplicación en modelos in vivo, deben considerarse varias formas de control, tales como patogenicidad bacteriana, empleo de bacterias atenuadas o modificadas genéticamente, empleo de antibióticos después del tratamiento o el ajuste de la dosis bacteriana.
Este trabajo nos ha servido como prueba de concepto para poder preparar nanosistemas más elaborados con sistemas de estímulo-respuesta, elementos de targeting, o incluso que desanclen las nanopartículas ante determinado estímulo como enzimas presentes en el entorno tumoral. En ese nuevo reto estamos trabajando.
Referencia
Moreno, V. M.; Álvarez, E.; Izquierdo-Barba, I.; Baeza, A.; Serrano-López, J.; Vallet-Regí, M. Bacteria as Nanoparticles Carrier for Enhancing Penetration in a Tumoral Matrix Model, Advanced Materials Interfaces, 2020. DOI: 10.1002/admi.201901942.
María Vallet-Regí
Académica de la RANF


