Como es sabido, las glicoproteínas S, situadas en las espículas del virus, son dianas de vacunas, anticuerpos terapéuticos y métodos de diagnóstico porque son fundamentales en la entrada en el organismo de SARS-CoV2 (y también de otros coronavirus). Dicha entrada requiere que el dominio de enlace al receptor (RBD) de la subunidad S1 interaccione con los receptores humanos ACE2 (enzima convertidora de angiotensina 2) situados preferentemente en el exterior de las membranas celulares de distintos tejidos y órganos. ACE2 es una carboxipeptidasa que, entre otras funciones, contribuye a la degradación de varios sustratos fisiológicos como las angiotensinas I y II (Ang I y II), a los que convierte en Ang-(1-9) y Ang-(1-7) respectivamente. Las glicoproteínas S son trímeros de un péptido formado por dos subunidades llamadas S1 y S2. Las subunidades S1 contienen el dominio de enlace al receptor, mientras que las S2 se anclan en la membrana y participan en la maquinaria de fusión (Follis et al., 2006). Antes de la fusión, S se encuentra en una conformación metaestable que sufre una importante reestructuración cuando su subunidad S1 se une al receptor ACE2. El estudio de estos trímeros por criomicroscopía ha mostrado que el dominio de enlace al receptor (RBD) de la subunidad S1 experimenta dos cambios conformacionales, ‘up’ y ‘down’, que lo hacen accesible o inaccesible a ACE2. También se ha demostrado que para que se produzca la interacción de S con ACE2 y la fusión entre ambas membranas, es necesario el cebado previo (activación) de las proteínas S con proteasas del hospedador. En los gammacoronavirus y algunos betacoronavirus como SARS-CoV-2, la proteína S se rompe primero en el lugar S1/S2 por la acción de una proteína convertasa denominada furina y después de esta ruptura actúa la proteasa de serina de transmembrana 2 (TMPRSS2), que rompe la subunidad 2 por el lugar S2’ y permite la exposición del péptido de fusión (Bestle et al., 2020).
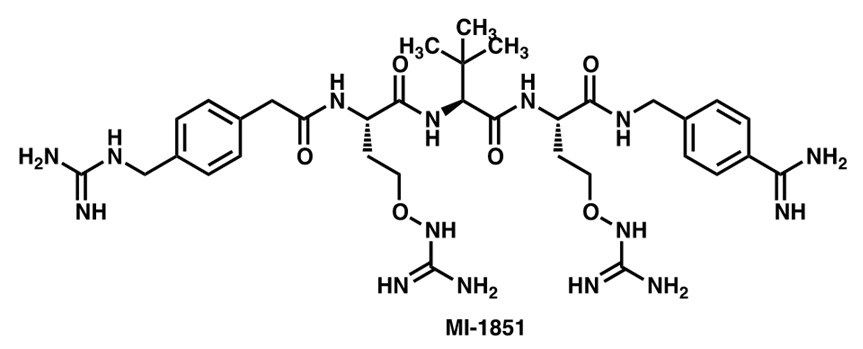
La furina es una proteína de transmembrana que se expresa de forma ubicua en las células eucarióticas e hidroliza precursores de muy distintas proteínas (hormonas, factores de crecimiento y moléculas de adhesión, entre otras). Es de gran importancia en la embriogénesis, y es fundamental en la propagación del virus de la gripe aviar H7N1 (altamente patógena) porque activa la hemaglutinina responsable de la unión del virus a la célula infectada. También activa otras glicoproteínas de los virus Dengue, Zika, Chikungunya, sarampión y paperas, entre otros. Por ello, su inhibición es potencialmente útil para impedir la propagación de estos virus. La ruptura de sus sustratos ocurre preferente detrás de un residuo de arginina (Arg) en una secuencia multibásica que contiene otros restos de este aminoácido, y sus inhibidores más activos son peptidomiméticos que incluyen, entre otras modificaciones estructurales, restos de Arg más o menos modificados. El compuesto MI-1851, que deriva del peptidomimético 4-guanidinometil-fenilacetil-Arg-Val-Arg-4-amidinobencilamida, en el que los dos residuos de arginina se han sustituido por canavanina (Becker et al., 2012), inhibe fuertemente la replicación de SARS-CoV-2 (Bestle et al., 2020).
TMPRSS2 es una proteasa de serina regulada por andrógenos que posee una actividad semejante a la tripsina, y se expresa en el epitelio del tracto respiratorio, gastrointestinal y urogenital, jugando un importante papel en la activación proteolítica y la invasión por virus de la gripe, SARS-CoV y MERS, entre otros. Como ya se ha comentado, esta enzima escinde la subunidad S2 para que se produzca la interacción de la subunidad S1 con ACE2. Por otra parte, la acción de la metaloproteasa 17 (ADAM17) sobre ACE2 unida a la membrana produce el desprendimiento de dominios extracelulares de esta enzima, originando su forma soluble que ya no puede mediar la entrada de SARSCov-2 porque, aunque se una a la proteína S, las partículas víricas se mantienen en solución.
Hay que decir que la interacción de Ang II con sus receptores tipo 1 (AT1R) induce la sobreexpresión de ADAM17, por lo que su bloqueo podrían evitar la separación de ACE2 soluble (figura 1).
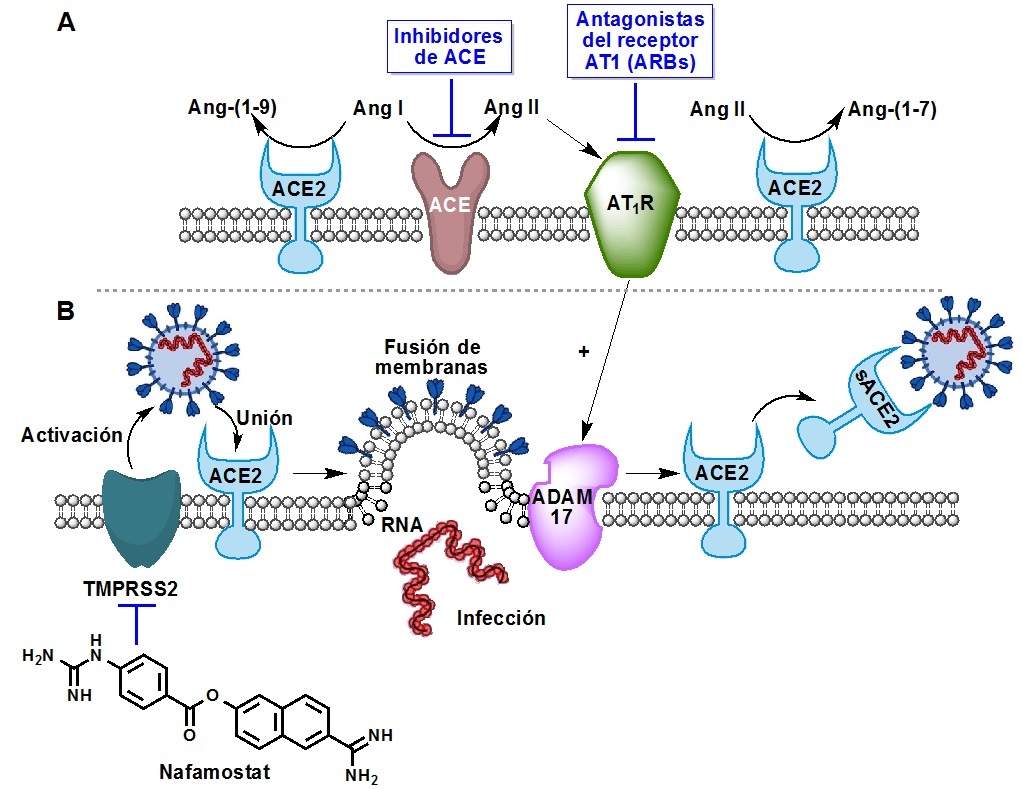
Figura 1. Algunos procesos implicados en la fusión de SARS-CoV-2 con las células del hospedador y mecanismo de acción del nafamostat.
El mesilato de camostat (aprobado en Japón para el tratamiento de la pancreatitis crónica y la esofagitis por reflujo postoperatorio) y su análogo mesilato de nafamostat (10 veces más activo y utilizado en Japón para el tratamiento de la pancreatitis aguda y en Europa para el tratamiento de la fibrosis quística), son bloqueantes de TMPRSS2 cuyo estudio en tratamientos experimentales de SARS-CoV-2 ha comenzado en Japón y en India (figura 1) (Hoffmann et al., 2020a; Hoffmann et al., 2020b).
Curiosamente, en el cribado de una biblioteca de compuestos activos frente a TMPRSS2 para descubrir supresores de la metástasis de cáncer de próstata, se observó que la
bromhexina (un agente mucolítico expectorante comercializado en 1963 con el nombre de Bisolvon®) es un potente y selectivo inhibidor de dicha enzima, por lo que se propuso como candidato para el tratamiento de las infecciones producidas por los virus SARS- CoV y MERS (Shen et al., 2017), y actualmente se ha sugerido su reposicionamiento en SARC-CoV-2 (Maggio, 2020).
Las diferencias en los procesos de activación de las glicoproteínas S en SARS-CoV y SARS-CoV-2 pueden explicar, al menos en parte, su diferente comportamiento, aunque ambos utilizan el mismo receptor y sus proteínas S tienen un alto grado de homología. En células humanas, la proteolisis de SARS-S es menos activa que la de SARS-2-S. El hecho de que SARS-CoV-2 posea un lugar de ruptura S1/S2 polibásico, le permite conectar con tejidos muy diferentes del cuerpo humano, afectando además de al epitelio pulmonar al endotelio vascular, al intestinal, etc. Por el contrario, el RBD de SARS-S posee un solo resto de arginina y no es sustrato de la ubicua furina, por lo que puede conectar con pocos tipos de tejidos afectando a menos órganos (Coutard et al., 2020). Esta diferencia tiene consecuencias funcionales que afectan al ciclo viral, a su patogenia, y al desarrollo de antivirales específicos SARS-CoV-2. Éste se ha mostrado menos letal que SARS-CoV pero con un poder de transmisión de hombre a hombre mucho mayor. Por otra parte, SARS-CoV afecta fundamentalmente al aparato respiratorio mientras que SARS-CoV-2 afecta a una gran diversidad de órganos en todo el cuerpo. También es diferente su reactividad frente a anticuerpos, ya que los específicos del RBD de SARS-CoV no se enlazan al RBD de SARS-CoV-2, un indicio de que no hay reactividad cruzada.
Desde el punto de vista terapéutico, además de los anticuerpos neutralizantes de la proteína S, los inhibidores de TMPRSS2 y de furina, así como la regulación positiva de ADAM17, podrían evitar la entrada de SARS-CoV-2 en las células, mientras que el uso de la proteína ACE2 recombinante soluble impediría que el virus se una a la ACE2 anclada en la membrana plasmática celular. La enzima TMPRSS2 del hospedador es una diana de fármacos interesante porque siendo crítica para la propagación de estos virus su papel fisiológico es poco relevante, por lo que su inhibición afectaría principalmente a la propagación vírica. En combinación, los inhibidores de TMPRSS2 y de furina pueden actuar sinérgicamente suprimiendo completamente la ruptura de las proteínas S y evitando resistencias al poderse utilizar con menores dosis.
Referencias
Becker, G.L.; Y. Lu; K. Hardes; B. Strehlow; Ch. Levesque; I. Lindberg; K. Sandvig; U. Bakowsky; R. Day; W. Garten; T. Steinmetzer. Highly Potent Inhibitors of Proprotein Convertase Furin as Potential Drugs for Treatment of Infectious Diseases. J. Biol. Chem. (2012), 287, 21.992-22.003. [doi.org: 10.1074/jbc.M111.332643].
Bestle, D.; M.R. Heindle; H. Limburg; T.V. Lam van; O. Pilgram; H. Moulton; D. A. Stein; K. Hardes; M. Eickmann; O. Dolnik; C. Rohde; S. Becker; H.-D. Klenk; W. Garten; T. Steinmetzer; E. Böttcher-Friebertshäuser. TMPRSS2 and furin are both essential for proteolytic activation and spread of SARS-CoV-2 in human airway epithelial cells and provide promising drug targets. HebioRxiv (2020), preprint. [doi.org: https://doi.org/10.1101/2020.04.15.042085].
Coutard, B; C. Valle; X. de Lamballerie; B. Canard; N.G. Seidah; E. Decroly. The spike glycoprotein of the new coronavirus 2019-nCoV contains a furin-like cleavage site absent in CoV of the same clade. Antiviral Res. (2020), 176, 104742.
Follis, K. E.; J. York; J.H. Nunberg. Furin cleavage of the SARS coronavirus spike glycoprotein enhances cell-cell fusion but does not affect virion entry. Virology (2006), 350, 358-69.
Hoffmann, M.; H. Kleine-Weber; S. Schroeder; N. Krüger; T. Herrler; S. Erichsen; T.S. Schiergens; G. Herrler; N.-H. Wu; A. Nitsche; M.A. Müller; C. Drosten; S. Pöhlmann. SARS-CoV-2 Cell Entry Depends on ACE2 and TMPRSS2 and Is Blocked by a Clinically Proven Protease Inhibitor. Cell (2020), 181: 271-280. [doi.org/10.1016/j.cell.2020.02.052].
Hoffmann, M.; S. Schroeder; H. Kleine-Weber; M.A. Müller; C. Drosten; S. Pöhlmann. Nafamostat Mesylate Blocks Activation of SARS-CoV-2: New Treatment Option for COVID-19. Antimicrob. Agents Chemother. (2020), 64, e00754-20. [doi.org/10.1128/AAC.00754-20.
Maggio, R. Repurposing the mucolytic cough suppressant and TMPRSS2 protease inhibitor bromhexine for the prevention and management of SARS-CoV-2 infection. Pharmacol. Res. (2020), 157, 104837.
Shen, L.W.; H.J. Mao; Y.L. Wu; Y, Tanaka; W. Zhang. TMPRSS2: a potential target for treatment of influenza virus and coronavirus infections. Biochimie (2017), 142, 1-10.
Wu, F.; S. Zhao; B. Yu; Y.-M. Chen; W. Wang; Z.-G. Song; Y. Hu; Z.-W. Tao; J.-H. Tian; Y.-Y. Pei, M.-L. Yuan; Y.-L. Zhang; F.H. Dai; Y. Liu; Q.-M. Wang; J.-J. Zheng; L. Xu; E. C. Holmes; Y.-Z. Zhang. A new coronavirus associated with human respiratory disease in China. Nature (2020), 579, 265–269.
Carmen Avendaño
Académica de la RANF



