La tecnología analítica de procesos (PAT) se puede definir como un sistema para medir los parámetros críticos de proceso (CPP) que afectan a los atributos críticos de calidad (CQA) de los productos farmacéuticos durante su desarrollo y fabricación, siguiendo los principios de Calidad por Diseño (QbD).
Según la directriz ICH-Q8 (ICH, 2009), la QbD se define como “un enfoque sistemático que comienza con unos objetivos previamente definidos y que enfatiza la comprensión de los productos y de los procesos y el control del proceso, basándose en el rigor científico y en la gestión de riesgos para la calidad”.
Además, de acuerdo con la guía PAT de la FDA (FDA, 2004), la tecnología analítica de proceso se considera “como un sistema para diseñar, analizar y controlar la fabricación a través de mediciones oportunas (es decir, durante el proceso) de atributos críticos de calidad y rendimiento de materias primas y productos intermedios, con el objetivo de garantizar la calidad del producto final”.
Ninguna de las autoridades sanitarias tiene como requerimiento el uso de técnicas específicas para PAT, pero la realidad es que se usan ampliamente técnicas como la espectroscopía Raman, la espectroscopía de infrarrojo cercano (NIR) o el proceso de imágenes químicas. Sin embargo, se pueden aplicar otras técnicas, fáciles de usar y más baratas que las mencionadas anteriormente, para determinar los parámetros críticos de proceso (CPP). El análisis de espectro sonoro es una de estas técnicas.
En la comunicación se presentaron y discutieron algunos ejemplos relacionados con el uso del análisis de espectro sonoro de pasos críticos en el desarrollo y control de fabricación de formulaciones tópicas.
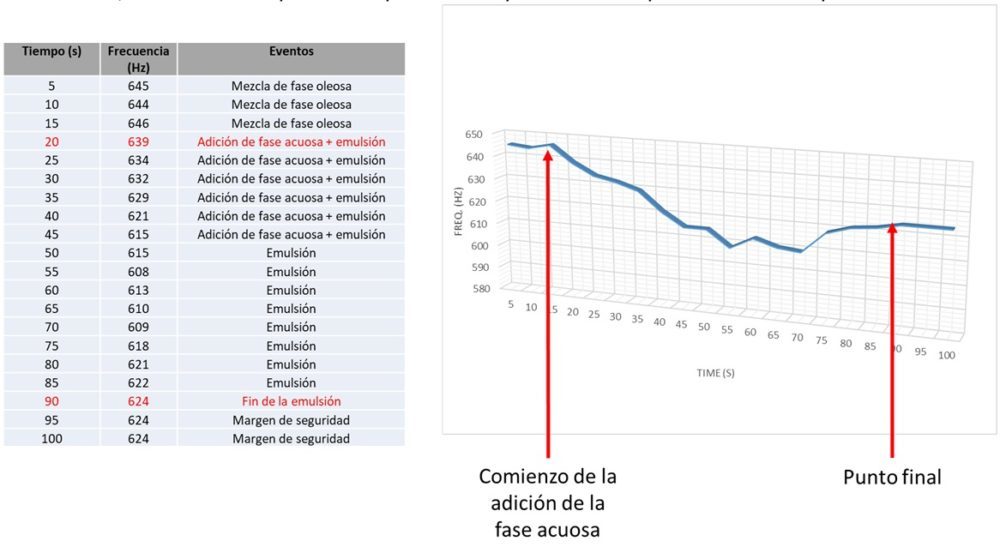
En la figura siguiente se muestra el caso de un proceso de emulsión, donde se observa una caída de la frecuencia del sonido emitido por el motor de un reactor a escala de laboratorio, con una recuperación posterior que indica el punto final del proceso.
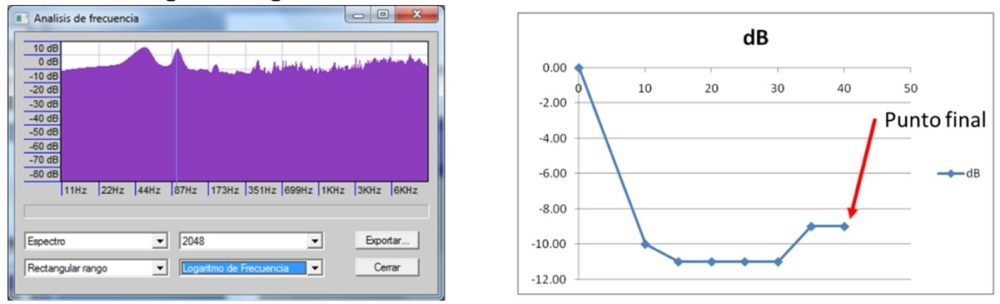
Se comentó, también, el resultado del análisis de espectro sonoro en un proceso de molienda de principio activo en el que no hay modificación de la frecuencia del sonido emitido por un molinillo, pero sí un cambio en su intensidad, medida en dB, como se observa en la siguiente figura:
Finalmente se expusieron las principales ventajas y las limitaciones del análisis de espectro sonoro:
Como ventajas:
– La utilización de software gratuito (‘freeware’) y ordenadores personales.
– La velocidad para obtener información valiosa sobre el proceso en desarrollo o control.
– La posibilidad de conectar señales de sonido específicas a controladores lógicos programables (PLC) u otros tipos de controladores.
– La mejora significativa del diseño final de un proceso de formulación tópica.
– La aplicación de esta tecnología en el desarrollo de otras formas farmacéuticas.
Como limitaciones:
– La imposibilidad de utilización de esta técnica si no hay cambios en el sonido emitido por el equipo utilizado.
– El uso relativamente extendido del análisis espectral de sonido en estudios de fisiología (Orizio et als., 1990) o práctica clínica (Xu et als., 2010; Jane et als.,1998), pero su limitada experiencia como herramienta PAT (Serris et als., 2002; Medendorp, Lodder, 2006).
Referencias:
FDA. Food & Drug Administration. Guidance Document Pat – A Framework for Innovative Pharmaceutical Development, Manufacturing, and Quality Assurance Guidance for Industry [October 2004]. [https://www.fda.gov/regulatory-information/search-fda-guidance-documents/pat-framework-innovative-pharmaceutical-development-manufacturing-and-quality-assurance][ (acceso: 10/05/2020).
ICH. International Conference on Harmonisation of Technical Requirements for Registration of Pharmaceuticals for Human Use. ICH harmonised tripartite guideline pharmaceutical development Q8 (R2). Current Step 4 version. [August 2009]. [ https://database.ich.org/sites/default/files/Q8%28R2%29%20Guideline.pdf] (acceso: 10/05/2020)
Jane, R.; D. Salvatella, J. A. Fiz; J. Morera. Spectral analysis of respiratory sounds to assess bronchodilator effect in asthmatic patients. Proceedings of the 20th Annual International Conference of the IEEE Engineering in Medicine and Biology Society (1998), 20 [Biomedical Engineering Towards the Year 2000 and Beyond]. Hong Kong, 3203-3206.
Medendorp, J.; R.A. Lodder. Acoustic-resonance spectrometry as a process analytical technology for rapid and accurate tablet identification. AAPS PharmSciTech (2006), 7, E175–E183.
Orizio, C.; R. Perini; B. Diemont; M. Maranzana Figini; A. Veicsteina. Spectral analysis of muscular sound during isometric contraction of biceps brachii. Journal of Applied Physiology (1990), 68(2), 508-512.
Serris, E.; L. Perier-Camby; G. Thomas; M. Desfontaines; G. Fantozzi. Acoustic emission of pharmaceutical powders during compaction. Powder Technology (2002), 128(2/3), 296-299.
Xu, Huijie; Weining Huang; Lisheng Yu; Lan Chen. Sound spectral analysis of snoring sound and site of obstruction in obstructive sleep apnea syndrome. Acta Oto-Laryngologica (2010), 130(10), 1175-1179.
Fernando Ferrándiz
Académico correspondiente electo



