En la tarde del martes 22 de febrero tuvo lugar la segunda mesa redonda del ciclo sobre “Epistemología, metodología y regulación de la medición científica en el ámbito clínico”, en esta ocasión dedicada a “Futuros cambios en la regulación de medicamentos y nuevos paradigmas para su autorización”; fue presentada y moderada por el Excmo. Sr. D. Antonio González Bueno. Actuaron como ponentes el Ilmo. Sr. D. Emili Esteve Sala y el Dr. D. César Hernández García.
El Dr. Emili Esteve se ocupó de los “Aspectos generales de la regulación del medicamento”; comenzó su intervención definiendo el ciclo de vida del medicamento y planteando unas reflexiones en torno a la llegada del producto al paciente en el menor tiempo posible, amparado por los nuevos cambios regulatorios avalados en la nueva Estrategia Farmacéutica para Europa emanada desde la Comisión Europea. Entre las propuestas formuladas desde la industria farmacéutica señaló el refuerzo de la evaluación basada en los conocimientos especializados, con un marco de autorización centralizado más ágil; la mejora del marco de vías aceleradas de apoyo a la innovación; la ampliación del papel de la Agencia Europea de Medicamentos [EMA] en la evaluación de las combinaciones de medicamentos y productos sanitarios y la sustitución del prospecto en papel por versiones electrónicas; en definitiva, adaptar el ciclo del medicamento a las nuevas exigencias para hacer más ágil el proceso de autorización de comercialziación.
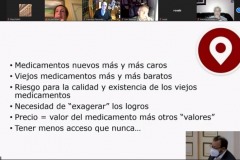
Por su parte, el Dr. César Hernández García disertó sobre “Representatividad clínica, consistencia, validación, subrogación, evaluación. Los futuros requisitos para acceder al mercado”. Comenzó su presentación ofreciendo un panorama de la actual situación del medicaento: productos nuevos, cada vez más caros, y productos envejecidos, a un precio cada vez más barato, lo que supone –en ambos casos- un grave problema de acceso a los medicamentos. Solventar esta cuestión exige conocer la situación actual del mercado del medicamentos que definió sobre tres pilares: la mayor formación de los pacientes, a través de sus asociaciones; el acceso a la información facilitado por las nuevas tecnologías de big data; y la individualidad de los trabajos desarrollados tanto por la industria como por las agencias reguladoras, una situación que debe cambiar hacia opciones de trabajo más colaborativo entre todos los agentes implicados. La Unión Europea está intentando abordar esta situacion a través de la Estrategia Farmacéutica para Europa, cuyas líneas generales tienen como base la experiencia adquirida tras la pandemia de Covid, la accesivilidad y asequibilidad de los medicamentos, el apoyo a la investigación y a los procesos de digitalización y la reducción de las situaciones de desabastecimiento. A lo largo de su conferencia expuso las estrategias de la Unión Europea sobre estos aspectos.
Tras las ponencias tuvo lugar un debate en el que participaron tanto los académicos presentes como los que siguieron la sesión on line.